对于癌症疗法而言,每年会有数十种新疗法进入临床试验,但最终只有不到4%的药物获得FDA的批准。尽管造成这一结果的影响因素有很多,但主要问题在于,我们并不完全了解特定癌症对治疗的反应方式或原因。因此,目前无法以最佳方式将合适的药物组合,并与合适的患者相匹配。
不过,
人工智能的出现或许能助我们一臂之力。大多数机器学习模型都是“黑匣子”,它们不需要了解或关注预测结果的生物学机制,就能针对预测准确性进行优化。
近日,来自美国加州大学圣地亚哥分校医学院的研究人员表示,他们已经创建了一个名为DrugCell的
新人工智能(AI)系统,该系统让肿瘤与最佳药物组合相匹配成为可能。使用DrugCell,在输入有关肿瘤的数据后,系统会返回最知名的药物、控制对该药物反应的生物学途径以及最佳药物组合。相关研究成果发表于《Cancer cell》上。
https://doi.org/10.1016/j.ccell.2020.09.014
先前,研究人员开发出一个可见神经网络(VNN),用于模拟简单的真核细胞——酿酒酵母。该系统能够准确预测基因突变对细胞生长反应的影响,同时确定驱动这些预测的最相关的分子途径。
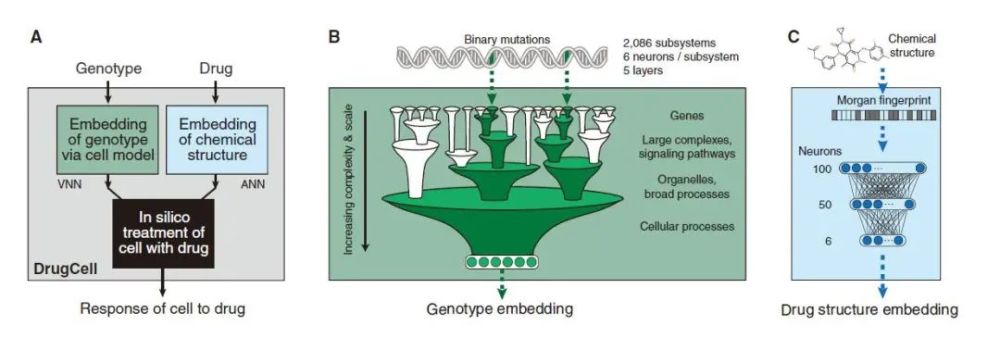
在此基础上,他们创建了一种名为“DrugCell”的VNN,可模拟人类癌细胞对治疗性化合物的反应。DrugCell将模型的内部工作原理与人类细胞生物学的层次结构相结合,从而可以预测任何癌症中任何药物的反应,并设计有效的联合疗法。
细胞药物反应是一个复杂的现象,取决于生物学和化学因素。为了在可解释的模型中捕获药物反应的这两个决定因素,研究人员将DrugCell设计为具有两个分支的神经网络,第一个分支是VNN,它是根据人类基因(GO)数据库中记录的2086个生物过程建模的,用于模拟人类细胞中分子子系统的层次结构。这些子系统中的每一个,从涉及小蛋白复合物(例如b-连环蛋白破坏复合物)到较大的信号传导途径(例如MAPK信号传导途径)到总体细胞功能(例如糖酵解)的子系统,都分配了一组人工神经元来代表该子系统的状态。VNN总共使用了12516个神经元,这些神经元分层分布在六个不同的层中。
DrugCell 设计
DrugCell的第二个分支是传统的人工神经网络(ANN),其中嵌入了药物的Morgan指纹,即化学结构的标准向量表示形式。该模型中两个分支(VNN嵌入细胞基因型和ANN嵌入药物结构)的输出被合并到单层神经元中,然后被整合以产生给定基因型对特定治疗的反应。此外,该模型通过对1,235种肿瘤细胞系对684种药物的反应进行了训练。
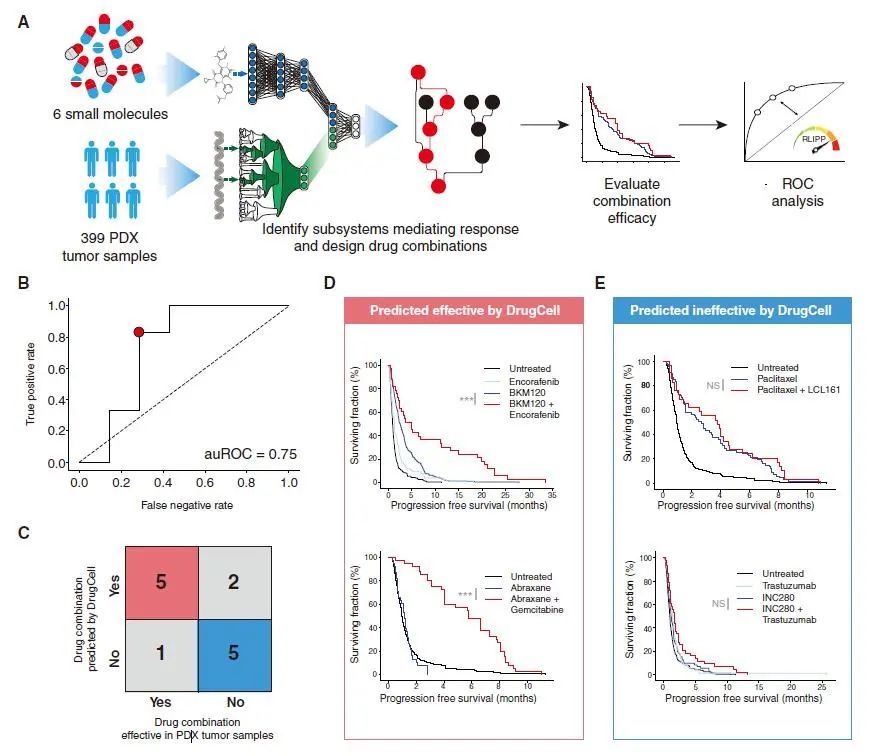
结果表明,DrugCell能够准确预测细胞系对治疗的反应(所有细胞系-药物对的总准确度为:spearman相关系数=0.80)。此外,预测的组合改善了患者来源的异种移植肿瘤模型中的无进展生存期,并且可以将ER阳性乳腺癌患者的临床结果分层。
研究的所有(细胞系,药物)对中,预测与实际的药物反应
源自患者的异种移植肿瘤的联合指导治疗
DrugCell共接受了1200多种肿瘤细胞系对近700种FDA批准药物和实验性治疗药物的反应的培训,总共有500,000多种细胞系/药物配对。
第一作者Kuenzi说:“我们对DrugCell从实验室细胞系转化为小鼠和患者的肿瘤以及临床试验数据的能力感到惊讶。但我们的最终目标是使DrugCell进入诊所,为患者谋福利。因此,仍有许多工作要做。”
研究人员同时强调,虽然1200个细胞系是一个好的开始,但它不能代表癌症的完全异质性。研究团队现在正在添加更多的单细胞数据,并尝试不同的药物结构。他们还希望与现有的临床研究合作,将DrugCell嵌入诊断工具中,并在现实中对其进行
前瞻性测试。